再生医療の実現化への
取り組み
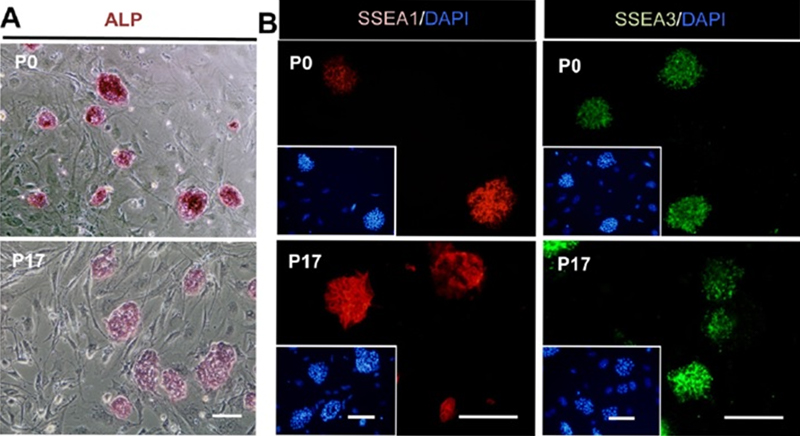
当社の自動細胞継代培養システムで培養したマウスiPS細胞(Koike, Kubota, Sekine et al. BMC Biotechnology 2012, 12:81)
上段P0は培養開始時の様子、下段P17は17回の操作後の様子。Aは透過光での染色像、Bは蛍光観察での染色像。

新しい医療技術の実現に向けて
有効な治療法がなかった疾患に効果が期待される、新しい治療法
再生医療は体外で培養した再生組織・細胞等を用いる新しい治療法であり、これまで有効な手段がなかった様々な疾患に対しても効果が期待されています。
この再生医療を誰でも受けられるように普及させるには、基礎研究・臨床研究に加え、産業利用可能な規模での実用化技術が必要です。つまり、細胞や組織を加工し、病院へ提供、さらには患者様への投与と経過フォローまで、高い安全性・信頼性と経済性のもとで一連のサイクルを実現させなければなりません。このサイクルを実現するためには大学・研究機関や病院に加え、様々な企業も力を合わせて知恵を絞ることが、求められているのです。
このような状況において、弊社も再生医療の実現化を推進すべく、再生医療分野に貢献してきました。
 はじまりは
はじまりは
「アクチビン」
千代田は宇宙での細胞培養実験に参加。
受精卵から心臓や肝臓、さらには神経等の分化を司る物質「アクチビン」による
細胞からの組織分化メカニズムの研究を行う。
卵から親になる生物の仕組みについて、多くの人々が長い間興味を持ち続けていました。このような疑問について研究を行う学問を発生生物学といいます。発生とは、配偶子が結合しその受精卵が細胞分裂を繰り返しながら成体になる、生物の形作りが行われる現象を指します。例えば、カエルの受精卵はやがて幼生であるオタマジャクシとなり、カエルという成体に変化します。この発生の間に受精卵から様々な器官や臓器ができます。
発生生物学の第一人者である浅島誠氏(現 東京大学教名誉教授)は、両生類における発生の研究を通じて、受精卵から心臓や筋肉、さらには膵臓等の分化を司る物質である「アクチビン」を発見し、その作用メカニズムを明らかにしました。
その浅島氏と宇宙航空研究開発機構(当時名称は宇宙開発事業団)は、1990年代より宇宙の無重力環境でのアクチビンによる細胞からの組織分化メカニズムを明らかにする研究を行っており、千代田化工建設はこの研究に協力する機会を得ました。それは、研究室で行われていた細胞操作に工学的な手法を導入し、宇宙の厳しい環境下で、安全且つ高い信頼性を実現しつつ、可能な限り自動で細胞培養・回収を行うシステムの開発でした。
本システムを活用した宇宙での細胞培養実験は2009年に完了しましたが、ここで得られた知見や技術は弊社にとっても発生生物学の発展にとっても大きな成果でした。
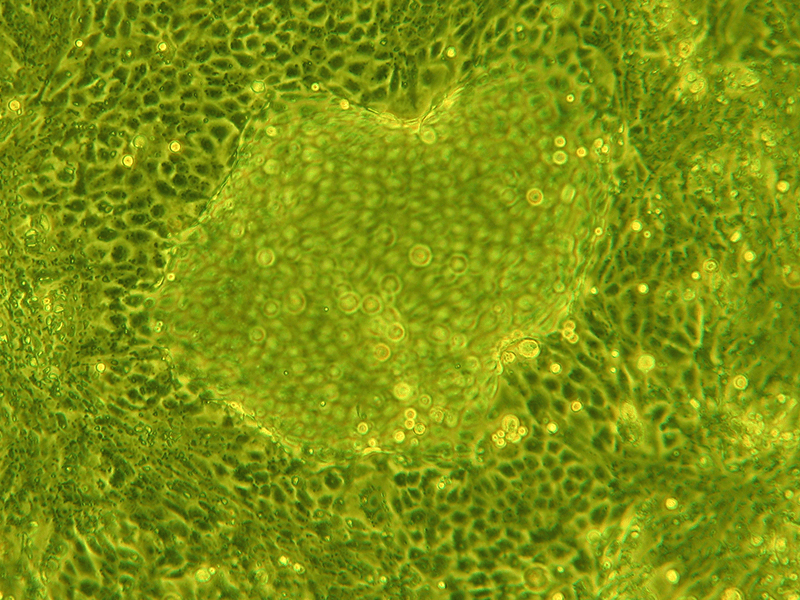
微小重力環境で培養したアフリカツメガエルの細胞(ご提供 東京理科大学 浅島誠氏および産業技術総合研究所 伊藤弓弦氏)
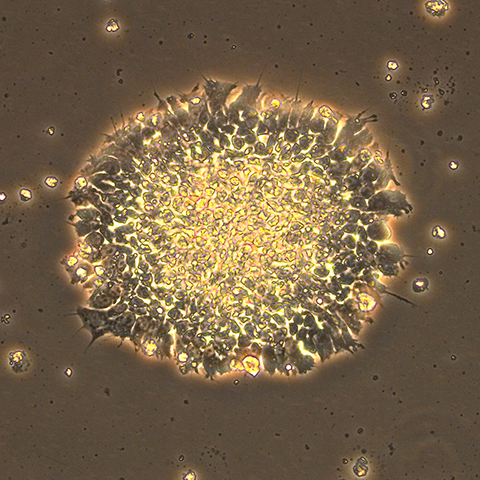
当社研究施設にて培養したヒトiPS細胞
再生医療の実用化への挑戦
大きな可能性を秘めるiPS細胞。
社会の多くの機関や関係者、企業と連携し、
この新しい治療法の実用化を目指す。
再生医療普及に向けてブレークスルーを実現する技術として期待されるものが「iPS細胞の利用」です。2006年に山中伸弥氏(現 京都大学iPS細胞研究所所長・教授)によって確立され、2012年ノーベル生理学・医学賞の受賞対象となったiPS細胞は、様々な人々に適合した組織を柔軟に生産できる出発点の細胞として大きな可能性を秘めています。
現在、日本では、産官学で総力を挙げてこのiPS細胞を活用した再生医療の実用化に向け、研究開発及び事業開発が精力的に進められております。しかし、実用化に関しては安全な製品の量産化や流通方法の確立等の多くの課題が存在します。
私たちは、医薬品エンジニアリングで培った医療・医薬安全性に関わる知見に加え、宇宙開発で培った工学的な細胞操作手法を活用し、医療で求められる品質を持つ細胞・組織を大量に培養・調製する技術の開発に取り組んでいます。
当然のことながら、再生医療の実現は弊社のみで達成できるものではありません。多くの研究機関や関係者、企業と連携し、それぞれの強みを発揮して力を合わせるでことで、この新しい治療法が実現できると考えています。私たちは、宇宙開発やプラント建設で培ったエンジニアリング力をこの分野に発揮し、再生医療関連製品を少しでも早く、多くの患者様にお届けすることを目指しています。

